Características clínicas de pacientes infectados com o novo coronavírus de 2019 em Wuhan, China
- Adaptação de Helena Brígido
- 26 de jan. de 2020
- 18 min de leitura
Chaolin Huang et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. The Lancet. 24 jan 2020. Available: https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)30183-5/fulltext#main-menu.
DOI:https://doi.org/10.1016/S0140-6736(20)30183-5
Um conjunto recente de casos de pneumonia em Wuhan, China, foi causado por um novo betacoronavírus, o novo coronavírus de 2019 (2019-nCoV). Relatamos as características epidemiológicas, clínicas, laboratoriais e radiológicas, o tratamento e os resultados clínicos desses pacientes.
RESULTADOS
Todos os pacientes com suspeita de 2019-nCoV foram admitidos em um hospital designado em Wuhan. Coletamos e analisamos prospectivamente dados de pacientes com infecção 2019 por nCoV confirmada em laboratório por RT-PCR em tempo real e sequenciamento de próxima geração. Os dados foram obtidos através de formulários padronizados de coleta de dados compartilhados pelo Consórcio Internacional de Respiração Aguda Grave e Infecções Emergentes, em prontuários eletrônicos. Os pesquisadores também se comunicaram diretamente com os pacientes ou suas famílias para verificar dados epidemiológicos e de sintomas. Os resultados também foram comparados entre os pacientes que foram admitidos, ou não, na unidade de terapia intensiva (UTI).
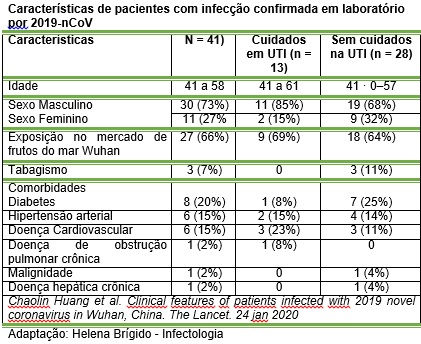
Até 2 de janeiro de 2020, 41 pacientes hospitalizados admitidos haviam sido identificados como tendo infecção confirmada por laboratório 2019-nCoV. A maioria dos pacientes infectados era do sexo masculino (30 [73%] de 41); menos da metade tinha doenças subjacentes (13 [32%]), incluindo diabetes (oito [20%]), hipertensão (seis [15%]) e doenças cardiovasculares (seis [15%]). A idade mediana foi de 49,0 anos (IQR 41,0-058,0). 27 (66%) dos 41 pacientes foram expostos ao mercado de frutos do mar de Wahun. Um cluster de família foi encontrado. Os sintomas comuns no início da doença foram febre (40 [98%] de 41 pacientes), tosse (31 [76%]) e mialgia ou fadiga (18 [44%]); sintomas menos comuns foram produção de escarro (11 [28%] em 39), dor de cabeça (três [8%] em 38), hemoptise (dois [5%] em 39) e diarréia (um [3%] em 38). A dispneia se desenvolveu em 22 (55%) dos 40 pacientes (tempo médio desde o início da doença até a dispneia 8,0 dias [IQR 5 · 0–13 · 0]). 26 (63%) dos 41 pacientes apresentaram linfopenia. Todos os 41 pacientes apresentaram pneumonia com achados anormais na TC do tórax. As complicações incluíram síndrome do desconforto respiratório agudo (12 [29%]), RNAemia (seis [15%]), lesão cardíaca aguda (cinco [12%]) e infecção secundária (quatro [10%]). 13 (32%) pacientes foram internados em UTI e seis (15%) faleceram. Comparados com pacientes não internados em UTI, os pacientes em UTI apresentaram níveis plasmáticos mais elevados de IL2, IL7, IL10, GSCF, IP10, MCP1, MIP1A e TNFα. 13 (32%) pacientes foram internados em UTI e seis (15%) faleceram. Comparados com pacientes não internados em UTI, os pacientes em UTI apresentaram níveis plasmáticos mais elevados de IL2, IL7, IL10, GSCF, IP10, MCP1, MIP1A e TNFα. 13 (32%) pacientes foram internados em UTI e seis (15%) faleceram. Comparados com pacientes não internados em UTI, os pacientes em UTI apresentaram níveis plasmáticos mais elevados de IL2, IL7, IL10, GSCF, IP10, MCP1, MIP1A e TNFα.
A infecção 2019-nCoV causou aglomerados de doenças respiratórias graves semelhantes ao coronavírus da síndrome respiratória aguda grave e foi associada à admissão na UTI e alta mortalidade. Grandes lacunas em nosso conhecimento da origem, epidemiologia, duração da transmissão humana e espectro clínico da doença precisam ser preenchidas por estudos futuros.
Introdução
Os coronavírus são vírus de RNA de sentido positivo não segmentados, pertencentes à família Coronaviridae e à ordem Nidovirales, amplamente distribuídos em humanos e outros mamíferos.1
Embora a maioria das infecções por coronavírus humano seja leve, as epidemias dos dois betacoronavírus, coronavírus da síndrome respiratória aguda grave (SARS-CoV)2 3 4 e coronavírus da síndrome respiratória do Oriente Médio (MERS-CoV),5 6 causaram mais de 10.000 casos cumulativos nas últimas duas décadas, com taxas de mortalidade de 10% para SARS-CoV e 37% para MERS-CoV.7 8 . Os coronavírus já identificados podem ser apenas a ponta do iceberg, com eventos zoonóticos potencialmente mais novos e graves a serem revelados.
Em dezembro de 2019, uma série de casos de pneumonia de causa desconhecida surgiu em Wuhan, Hubei, China, com apresentações clínicas muito semelhantes à pneumonia viral.9
A análise de sequenciamento profundo de amostras do trato respiratório inferior indicou um novo coronavírus, que foi nomeado 2019 de novo coronavírus (2019-nCoV). Até o momento, mais de 800 casos confirmados, inclusive em profissionais de saúde, foram identificados em Wuhan e vários casos exportados foram confirmados em outras províncias da China, Tailândia, Japão, Coréia do Sul e EUA.10 11 12 13
Evidências antes deste estudo
Os coronavírus humanos, incluindo hCoV-229E, OC43, NL63 e HKU1, causam doenças respiratórias leves. As infecções fatais por coronavírus que surgiram nas últimas duas décadas são coronavírus com síndrome respiratória aguda grave (SARS-CoV) e coronavírus com síndrome respiratória no Oriente Médio. Pesquisamos no PubMed e no banco de dados da China National Knowledge Infrastructure para artigos publicados até 11 de janeiro de 2020, usando as palavras-chave "novo coronovírus", "2019 novo coronavírus" ou "2019-nCoV". Nenhum trabalho publicado sobre a infecção humana causada pelo novo coronavírus de 2019 (2019-nCoV) foi identificado.
Valor agregado deste estudo
Relatamos as características epidemiológicas, clínicas, laboratoriais e radiológicas, tratamento e resultados clínicos de 41 casos confirmados em laboratório infectados com 2019-nCoV. 27 (66%) dos 41 pacientes tinham histórico de exposição direta ao mercado de frutos do mar de Wahun. A idade média dos pacientes foi de 49,0 anos (IQR 41,0-058,0) e 13 (32%) pacientes apresentavam doença subjacente. Todos os pacientes apresentaram pneumonia. Um terço dos pacientes foram admitidos em unidades de terapia intensiva e seis morreram. Altas concentrações de citocinas foram registradas no plasma de pacientes críticos infectados com 2019-nCoV.
Implicações de todas as evidências disponíveis
O 2019-nCoV causou aglomerados de pneumonia fatal com apresentação clínica muito semelhante à SARS-CoV. Pacientes infectados com 2019-nCoV podem desenvolver a síndrome do desconforto respiratório agudo, com alta probabilidade de internação em terapia intensiva e podem morrer. A tempestade de citocinas pode estar associada à gravidade da doença. Mais esforços devem ser feitos para conhecer todo o espectro e a fisiopatologia da nova doença.
Nosso objetivo é descrever características epidemiológicas, clínicas, laboratoriais e radiológicas, tratamento e resultados de pacientes com infecção por 2019-nCoV, e comparar as características clínicas entre pacientes em unidades de terapia intensiva (UTI) e não em UTI. Esperamos que os resultados de nosso estudo informem a comunidade global do surgimento desse novo coronavírus e de suas características clínicas.
PACIENTES
Após os casos de pneumonia de causa desconhecida relatados em Wuhan e considerando o histórico compartilhado de exposição ao mercado de frutos do mar Wahun entre os pacientes, um alerta epidemiológico foi lançado pela autoridade local de saúde em 31 de dezembro de 2019 e o mercado foi fechado em 1 de janeiro, 2020. Enquanto isso, 59 casos suspeitos com febre e tosse seca foram transferidos para um hospital designado a partir de 31 de dezembro de 2019. Uma equipe especializada de médicos, epidemiologistas, virologistas e funcionários do governo foi formada logo após o alerta.
Como a causa era desconhecida no início dessas infecções emergentes, o diagnóstico de pneumonia de causa desconhecida em Wuhan foi baseado nas características clínicas, na imagem do tórax e na exclusão de patógenos bacterianos e virais comuns que causam pneumonia. Os pacientes suspeitos foram isolados usando precauções no ar no hospital designado, Jin Yin-tan Hospital (Wuhan, China) e máscaras N95 testadas para ajuste e precauções no ar para procedimentos de geração de aerossóis. Este estudo foi aprovado pela Comissão Nacional de Saúde da China e pela Comissão de Ética do Hospital Jin Yin-tan (KY-2020-01.01). O consentimento informado por escrito foi dispensado pela Comissão de Ética do hospital designado para doenças infecciosas emergentes.
MÉTODOS
Centros locais de controle e prevenção de doenças coletaram amostras respiratórias, de sangue e de fezes e depois as enviaram para laboratórios autorizados para detectar o patógeno (NHC Key Laboratory of Systems Biology of Pathogens e Christophe Mérieux Laboratory, Beijing, China). Um novo coronavírus, chamado 2019-nCoV, foi isolado da amostra do trato respiratório inferior e um teste de diagnóstico para esse vírus foi desenvolvido logo depois.14
Dos 59 casos suspeitos, 41 pacientes foram confirmados como infectados com 2019-nCoV. A presença de 2019-nCoV em amostras respiratórias foi detectada pelos métodos de sequenciamento de próxima geração ou RT-PCR em tempo real. Foram utilizados os iniciadores e o gene alvo do envelope do CoV e as sequências foram as seguintes: iniciador direto 5'-TCAGAATGCCAATCTCCCCAAC-3 '; iniciador reverso 5'-AAAGGTCCACCCGATACATTGA-3 '; e a sonda 5′CY5-CTAGTTACACTAGCCATCCTTACTGC-3′BHQ1. As condições para as amplificações foram de 50 ° C por 15 min, 95 ° C por 3 min, seguidas de 45 ciclos de 95 ° C por 15 se 60 ° C por 30 s.
As investigações iniciais incluíram hemograma completo, perfil de coagulação e teste bioquímico sérico (incluindo função renal e hepática, creatina quinase, lactato desidrogenase e eletrólitos). Amostras respiratórias, incluindo zaragatoas nasais e faríngeas, líquido de lavagem broncoalveolar, escarro ou aspirados brônquicos foram testadas quanto a vírus comuns, incluindo influenza, influenza aviária, vírus sincicial respiratório, adenovírus, vírus da parainfluenza, SARS-CoV e MERS-CoV usando tempo real Ensaios de RT-PCR aprovados pela China Food and Drug Administration. Também foram realizados exames bacterianos e fúngicos de rotina.
Dado o surgimento dos casos de pneumonia 2019-nCoV durante a temporada de influenza, antibióticos (orais e intravenosos) e oseltamivir (oralmente 75 mg duas vezes ao dia) foram administrados empiricamente. A terapia com corticosteroides (metilprednisolona 40 a 120 mg por dia) foi administrada como regime combinado se a pneumonia grave adquirida na comunidade fosse diagnosticada por médicos no hospital designado. O suporte de oxigênio (por exemplo, cânula nasal e ventilação mecânica invasiva) foi administrado aos pacientes de acordo com a gravidade da hipoxemia. Testes repetidos para 2019-nCoV foram realizados em pacientes com infecção por 2019-nCoV para mostrar depuração viral antes da alta hospitalar ou descontinuação do isolamento.
COLETA DE DADOS
Revisamos prontuários, registros de enfermagem, achados laboratoriais e radiografias de tórax em todos os pacientes com infecção por nCoV 2019 confirmada por laboratório e que foram relatados pela autoridade de saúde local. Os dados de admissão desses pacientes foram de 16 de dezembro de 2019 a 2 de janeiro de 2020. Características epidemiológicas, clínicas, laboratoriais e radiológicas e dados de tratamento e resultados foram obtidos com formulários padronizados de coleta de dados (formulário de registro de caso modificado para infecção respiratória aguda grave) caracterização clínica compartilhada pelo Consórcio Internacional de Infecções Respiratórias Agudas Graves e Emergentes) de registros médicos eletrônicos. Dois pesquisadores também revisaram independentemente os formulários de coleta de dados para verificar novamente os dados coletados. Para verificar os dados epidemiológicos e dos sintomas, que não estavam disponíveis nos prontuários eletrônicos, os pesquisadores também se comunicaram diretamente com os pacientes ou suas famílias para verificar os dados epidemiológicos e dos sintomas.
MEDIÇÃO DE CITOCINAS E QUIMIOCINAS
Para caracterizar o efeito do coronavírus na produção de citocinas ou quimiocinas na fase aguda da doença, citocinas e quimiocinas plasmáticas (IL1B, IL1RA, IL2, IL4, IL4, IL5, IL6, IL7, IL8 (também conhecida como CXCL8), IL9, IL10, IL12p70, IL13, IL15, IL17A, Eotaxina (também conhecida como CCL11), FGF2 básico, GCSF (CSF3), GMCSF (CSF2), IFNγ, IP10 (CXCL10), MCP1 (CCL2), MIP1A (CCL3), MIP1B ( CCL4), PDGFB, RANTES (CCL5), TNFα e VEGFA foram medidos usando o painel Human Cytokine Standard 27-Plex Assays e o sistema Bio-Plex 200 (Bio-Rad, Hercules, CA, EUA) para todos os pacientes de acordo com as instruções do fabricante. As amostras de plasma de quatro adultos saudáveis foram usadas como controle para comparação cruzada.O tempo médio de transferência para um hospital designado para a coleta de amostras de sangue foi de 4 dias (IQR 2–5).
Detecção de coronavírus no plasma
Cada amostra de 80 μL de plasma dos pacientes e contatos foi adicionada a 240 μL de Trizol LS (10296028; Thermo Fisher Scientific, Carlsbad, CA, EUA) no laboratório de Nível de Biossegurança 3. O RNA total foi extraído pelo kit Direct-zol RNA Miniprep (R2050; Zymo research, Irvine, CA, EUA), de acordo com as instruções do fabricante, e 50 μL de eluição foram obtidos para cada amostra. Foi utilizado 5 μL de RNA para RT-PCR em tempo real, direcionado ao NPgene usando o Reagente RT-PCR de uma etapa AgPath-ID (AM1005; Thermo Fisher Scientific). A concentração final da mistura reaccional dos iniciadores foi de 500 nM e a sonda foi de 200 nM. A RT-PCR em tempo real foi realizada usando as seguintes condições: 50 ° C por 15 min e 95 ° C por 3 min, 50 ciclos de amplificação a 95 ° C por 10 se 60 ° C por 45 s. Como não realizamos testes para detectar vírus infecciosos no sangue, evitamos o termo viremia e usamos RNAaemia. A RNAemia foi definida como um resultado positivo para a RT-PCR em tempo real na amostra de plasma.
Definições
A síndrome do desconforto respiratório agudo (SDRA) e o choque foram definidos de acordo com as orientações provisórias da OMS para novos coronavírus.9
Hipoxemia foi definida como tensão arterial de oxigênio (PaO 2 ) sobre a fração inspiratória de oxigênio (FIO 2 ) inferior a 300 mm Hg.15
A lesão renal aguda foi identificada e classificada com base no nível mais alto de creatinina sérica ou nos critérios de produção de urina, de acordo com a doença renal, melhorando a classificação global dos resultados.16
A infecção secundária foi diagnosticada se os pacientes apresentassem sintomas clínicos ou sinais de pneumonia ou bacteremia nosocomial e foi combinada com uma cultura positiva de um novo patógeno de uma amostra do trato respiratório inferior (incluindo escarro, aspirados transtraceais ou líquido de lavagem broncoalveolar ou de amostras de sangue colhidas ≥ 48 h após a admissão).17
A lesão cardíaca seguiu a definição usada em nosso estudo anterior em pacientes H7N9.18
Em resumo, a lesão cardíaca foi diagnosticada se os níveis séricos de biomarcadores cardíacos (por exemplo, troponina I) estivessem acima do limite superior de referência do percentil 99, ou se novas anormalidades fossem mostradas na eletrocardiografia e ecocardiografia.
Detecção de coronavírus no plasma
As variáveis contínuas foram expressas em mediana (IQR) e comparadas com o teste U de Mann-Whitney; as variáveis categóricas foram expressas em número (%) e comparadas pelo teste do χ 2 ou pelo teste exato de Fisher entre os cuidados na UTI e nenhum grupo de cuidados na UTI. Boxplots foram desenhados para descrever as concentrações plasmáticas de citocinas e quimiocinas. Um α bilateral de menos de 0,05 foi considerado estatisticamente significativo. Análises estatísticas foram realizadas no software SAS, versão 9.4, a menos que indicado de outra forma.
Resultados
Até 2 de janeiro de 2020, 41 pacientes internados no hospital foram identificados como infecção confirmada em laboratório por 2019-nCoV em Wuhan. 20 [49%]) dos pacientes infectados com 2019 nCoV tinham entre 25 e 49 anos e 14 (34%) tinham entre 50 e 64 anos. A idade média dos pacientes foi de 49,0 anos (IQR 41,0-058,0). Em nossa coorte dos 41 primeiros pacientes a partir de 2 de janeiro, nenhuma criança ou adolescente foi infectado. Dos 41 pacientes, 13 (32%) foram admitidos na UTI porque necessitavam de cânula nasal de alto fluxo ou medidas de suporte de oxigênio de nível superior para corrigir a hipoxemia. A maioria dos pacientes infectados era do sexo masculino (30 [73%]); menos da metade tinha doenças subjacentes (13 [32%]), incluindo diabetes (oito [20%]), hipertensão (seis [15%]) e doenças cardiovasculares (seis [15%]). 27 (66%) pacientes tiveram exposição direta ao mercado de frutos do mar de Wahun. A exposição de mercado foi semelhante entre os pacientes com atendimento na UTI (nove [69%]) e aqueles com atendimento não na UTI (18 [64%]).

A data de início dos sintomas do primeiro paciente identificado foi em 1º de dezembro de 2019. Nenhum dos membros de sua família apresentou febre ou sintomas respiratórios. Não foi encontrado vínculo epidemiológico entre o primeiro paciente e os casos posteriores. O primeiro caso fatal, que teve exposição contínua ao mercado, foi internado no hospital devido a uma história de sete dias de febre, tosse e dispneia. Cinco dias após o início da doença, sua esposa, 53 anos, sem histórico conhecido de exposição ao mercado, também apresentou pneumonia e foi internada na enfermaria de isolamento.
Os sintomas mais comuns no início da doença foram febre (40 [98%] de 41 pacientes), tosse (31 [76%]) e mialgia ou fadiga (18 [44%]); os sintomas menos comuns foram produção de escarro (11 [28%] de 39), dor de cabeça (três [8%] de 38), hemoptise (dois [5%] de 39) e diarréia (um [3%] de 38), Mais da metade dos pacientes (22 [55%] dos 40) desenvolveu dispneia. A duração mediana do início da doença à dispneia foi de 8,0 dias (IQR 5, 0–13 · 0). O tempo médio desde o início dos sintomas até a primeira internação hospitalar foi de 7,0 dias (4 a 0 a 8,0), até a falta de ar foi de 8,0 dias (5 a 0 a 13,0) até SDRA foi de 9 a 0 dias (8 · 0–14 · 0), a ventilação mecânica foi de 10,5 dias (7 · 0–14 · 0) e a admissão na UTI foi de 10,5 dias (8 · 0–17 · 0).

As contagens sanguíneas dos pacientes na admissão mostraram leucopenia (contagem de glóbulos brancos menor que 4 × 10 9 / L; dez [25%] dos 40 pacientes) e linfopenia (contagem de linfócitos <1 · 0 × 10 9 / L; 26 [63 %] pacientes; tabela 2) O tempo de protrombina e o nível de dímero-D na admissão foram maiores nos pacientes em UTI (tempo médio de protrombina 12,2 s [IQR 11,2-2-13,4); nível médio de dímero D 2,4 mg / L [0,6-14 · 4]) que os pacientes que não fazem parte da UTI (tempo médio de protrombina 10,7 s [9 · 8–12 · 1], p = 0 · 012; nível médio de dímero D 0 · 5 mg / L [0 · 3–0 · 8], p = 0 · 0042). Os níveis de aspartato aminotransferase aumentaram em 15 (37%) de 41 pacientes, incluindo oito (62%) de 13 pacientes de UTI e sete (25%) de 28 pacientes de fora da UTI. A troponina I hipersensível (hs-cTnI) aumentou substancialmente em cinco pacientes, nos quais foi feito o diagnóstico de lesão cardíaca relacionada ao vírus.
A maioria dos pacientes apresentava níveis séricos normais de procalcitonina na admissão (procalcitonina <0,1 ng / mL; 27 [69%] pacientes; tabela 2 ). Quatro pacientes na UTI desenvolveram infecções secundárias. Três dos quatro pacientes com infecção secundária apresentaram procalcitonina maior que 0,5 ng / mL (0,69 ng / mL, 1,46 ng / mL e 6,48 ng / mL).
Na admissão, foram detectadas anormalidades nas imagens de TC de tórax em todos os pacientes. Dos 41 pacientes, 40 (98%) tiveram envolvimento bilateral. Os achados típicos das imagens de TC de tórax de pacientes em UTI na admissão foram múltiplas áreas lobulares e subsegmentares bilaterais de consolidação. Os achados representativos da TC do tórax de pacientes não internados em UTI mostraram opacidade bilateral em vidro fosco e áreas subsegmentares de consolidação. Imagens de TC de tórax posteriores mostraram opacidade bilateral em vidro fosco, enquanto a consolidação havia sido resolvida.

Imagens da TC do tórax de paciente cpm 2019n-Cov
(A) Imagens transversais de TC de tórax de um homem de 40 anos que apresentavam múltiplas áreas lobulares e subsegmentares de consolidação no dia 15 após início dos sintomas. Imagens transversais de TC de tórax de uma mulher de 53 anos mostrando opacidade bilateral em vidro fosco e áreas subsegmentares de consolidação no dia 8 após o início dos sintomas.
(B) e opacidade bilateral em vidro fosco no dia 12 após o início dos sintomas.
As concentrações plasmáticas iniciais de IL1B, IL1RA, IL7, IL8, IL9, IL10, FGF básico, GCSF, GMCSF, IFNγ, IP10, MCP1, MIP1A, MIP1B, PDGF, TNFα e VEGF foram maiores em pacientes de UTI e não em UTI do que em adultos saudáveis ( apêndice pp 6-7 ). Os níveis plasmáticos de IL5, IL12p70, IL15, Eotaxin e RANTES foram semelhantes entre adultos saudáveis e pacientes infectados com 2019-nCoV. Comparações adicionais entre pacientes na UTI e fora da UTI mostraram que as concentrações plasmáticas de IL2, IL7, IL10, GCSF, IP10, MCP1, MIP1A e TNFα foram maiores em pacientes na UTI do que em pacientes não na UTI.
Todos os pacientes apresentaram pneumonia. As complicações comuns incluíram SDRA (12 [29%] de 41 pacientes), seguida por RNAemia (seis [15%]), lesão cardíaca aguda (cinco [12%]) e infecção secundária (quatro [10%]). Foi necessária ventilação mecânica invasiva em quatro (10%) pacientes, sendo que dois (5%) apresentaram hipoxemia refratária e receberam oxigenação extracorpórea por membrana como terapia de resgate. Todos os pacientes foram administrados com tratamento antibiótico empírico e 38 (93%) pacientes receberam terapia antiviral (oseltamivir). Além disso, nove (22%) pacientes receberam corticosteróides sistemáticos. Uma comparação das características clínicas entre os pacientes que receberam e não receberam corticosteróides sistemáticos está no apêndice (pp 1–5).
Em 22 de janeiro de 2020, 28 (68%) dos 41 pacientes receberam alta e seis (15%) pacientes morreram. O condicionamento para alta teve como base a redução da febre por pelo menos 10 dias, com melhora das evidências radiográficas do tórax e liberação viral em amostras respiratórias do trato respiratório superior.
DISCUSSÃO
Relatamos aqui uma coorte de 41 pacientes com infecção 2019 por nCoV confirmada em laboratório. Os pacientes tiveram pneumonia grave, às vezes fatal, e foram admitidos no hospital designado em Wuhan, China, em 2 de janeiro de 2020. As apresentações clínicas se assemelham bastante ao SARS-CoV. Pacientes com doença grave desenvolveram SDRA e necessitaram de internação na UTI e oxigenoterapia. O tempo entre a internação e a SDRA foi de apenas 2 dias. Nesse estágio, a taxa de mortalidade é alta para 2019-nCoV, porque seis (15%) dos 41 pacientes dessa coorte morreram.
O número de mortes está aumentando rapidamente. Em 24 de janeiro de 2020, foram notificadas 835 infecções confirmadas em laboratório por 2019-nCoV na China, com 25 casos fatais. Foram divulgados relatórios de casos exportados em muitas províncias da China e em outros países; alguns profissionais de saúde também foram infectados em Wuhan. Tomadas em conjunto, as evidências até agora indicam a transmissão humana para 2019-nCoV. Estamos preocupados que 2019-nCoV possa ter adquirido a capacidade de transmissão humana eficiente.19
É altamente recomendável as precauções no ar, como um respirador N95 testado e outros equipamentos de proteção individual. Para evitar uma maior disseminação da doença nos serviços de saúde que atendem pacientes infectados com 2019-nCoV, o início da febre e os sintomas respiratórios devem ser monitorados de perto entre os profissionais de saúde. O teste de amostras respiratórias deve ser feito imediatamente quando houver suspeita de um diagnóstico. Os anticorpos séricos devem ser testados entre os profissionais de saúde antes e após a exposição ao 2019-nCoV para identificação de infecções assintomáticas.
Foram observadas semelhanças de características clínicas entre 2019-nCoV e infecções anteriores por betacoronavírus. Nesta coorte, a maioria dos pacientes apresentou febre, tosse seca, dispneia e opacidade bilateral em vidro fosco nas tomografias computadorizadas de tórax. Esses recursos da infecção 2019-nCoV têm alguma semelhança com as infecções por SARS-CoV e MERS-CoV.20 21
No entanto, poucos pacientes com infecção por 2019-nCoV apresentaram sinais e sintomas proeminentes do trato respiratório superior (por exemplo, rinorreia, espirros ou dor de garganta), indicando que as células-alvo podem estar localizadas nas vias aéreas inferiores. Além disso, os pacientes com 2019 nCoV raramente desenvolveram sinais e sintomas intestinais (por exemplo, diarréia), enquanto cerca de 20–25% dos pacientes com infecção por MERS-CoV ou SARS-CoV apresentavam diarreia.21
As amostras fecais e de urina devem ser testadas para excluir uma rota alternativa potencial de transmissão desconhecida neste estágio.
A fisiopatologia da patogenicidade invulgarmente alta para SARS-CoV ou MERS-CoV não foi completamente compreendida. Estudos anteriores mostraram que quantidades aumentadas de citocinas pró-inflamatórias no soro (por exemplo, IL1B, IL6, IL12, IFNγ, IP10 e MCP1) foram associadas à inflamação pulmonar e danos pulmonares extensos em pacientes com SARS.22
Também foi relatado que a infecção por MERS-CoV induzia concentrações aumentadas de citocinas pró-inflamatórias (IFNγ, TNFα, IL15 e IL17).23
Observamos que os pacientes infectados com 2019-nCoV também tinham grandes quantidades de IL1B, IFNγ, IP10 e MCP1, provavelmente levando a respostas celulares ativadas por T-helper-1 (Th1). Além disso, os pacientes que necessitaram de internação na UTI apresentaram maiores concentrações de GCSF, IP10, MCP1, MIP1A e TNFα do que aqueles que não necessitaram de internação na UTI, sugerindo que a tempestade de citocinas estava associada à gravidade da doença. No entanto, a infecção 2019-nCoV também iniciou o aumento da secreção de citocinas T-helper-2 (Th2) (por exemplo, IL4 e IL10) que suprimem a inflamação, que difere da infecção por SARS-CoV.22
Mais estudos são necessários para caracterizar as respostas Th1 e Th2 na infecção 2019-nCoV e elucidar a patogênese. Estudos de autópsia ou biópsia seriam a chave para entender a doença.
Tendo em vista a alta quantidade de citocinas induzidas por SARS-CoV,22 24 MERS-CoV, 25 26 e infecções por nCoV de 2019, os corticosteróides foram usados com frequência no tratamento de pacientes com doença grave, para possível benefício pela redução da lesão pulmonar induzida por inflamatória. No entanto, as evidências atuais em pacientes com SARS e MERS sugerem que o uso de corticosteróides não teve efeito na mortalidade, mas atrasou a depuração viral.27 28. 29. Portanto, os corticosteróides não devem ser administrados rotineiramente sistemicamente, de acordo com as orientações provisórias da OMS.30
Entre a nossa coorte de 41 pacientes confirmados em laboratório com infecção por 2019-nCoV, os corticosteróides foram administrados a muito poucos casos não-UTI, e a dose baixa a moderada de corticosteróides foi administrada a menos da metade dos pacientes gravemente enfermos com SDRA. Mais evidências são urgentemente necessárias para avaliar se o tratamento sistemático com corticosteroides é benéfico ou prejudicial para pacientes infectados com 2019-nCoV.
Nenhum tratamento antiviral para infecção por coronavírus demonstrou ser eficaz. Em um estudo de controle histórico,31 a combinação de lopinavir e ritonavir entre pacientes com SARS-CoV foi associada a um benefício clínico substancial (menos desfechos clínicos adversos). Arabi e colegas iniciaram um estudo controlado por placebo de interferon beta-1b, lopinavir e ritonavir entre pacientes com infecção por MERS na Arábia Saudita.32.
Evidências pré-clínicas mostraram a eficácia potente do remdesivir (um pró-fármaco antiviral nucleotídico de amplo espectro) no tratamento de infecções por MERS-CoV e SARS-CoV.33 34
Como 2019-nCoV é um vírus emergente, um tratamento eficaz não foi desenvolvido para doenças resultantes desse vírus. Uma vez que a combinação de lopinavir e ritonavir já estava disponível no hospital designado, foi iniciado rapidamente um estudo controlado randomizado para avaliar a eficácia e segurança do uso combinado de lopinavir e ritonavir em pacientes hospitalizados com infecção por 2019-nCoV.
Nosso estudo tem algumas limitações:
- Primeiro, para a maioria dos 41 pacientes, o diagnóstico foi confirmado com amostras do trato respiratório inferior e não foram obtidos swabs nasofaríngeos pareados para investigar a diferença na taxa de detecção de RNA viral entre amostras do trato respiratório superior e inferior. A detecção sorológica não foi realizada para procurar aumentos de 2019-nCoV em 18 pacientes com RNA viral indetectável.
- Segundo, com o número limitado de casos, é difícil avaliar os fatores de risco do hospedeiro para a gravidade e mortalidade da doença com métodos ajustados multivariáveis. Esta é uma série de casos de tamanho modesto de pacientes internados no hospital; a coleta de dados padronizados para uma coorte maior ajudaria a definir melhor a apresentação clínica, a história natural e os fatores de risco. Novos estudos em ambulatório, atenção primária, ou são necessárias configurações da comunidade para obter uma imagem completa do espectro da gravidade clínica. Ao mesmo tempo, a descoberta de testes estatísticos e valores de p deve ser interpretada com cautela, e valores não significativos de p não excluem necessariamente diferença entre pacientes de UTI e não de UTI.
- Terceiro, uma vez que o patógeno causador acaba de ser identificado, a cinética da carga viral e dos títulos de anticorpos não estava disponível. Finalmente, o possível viés de exposição em nosso estudo pode explicar por que nenhum paciente pediátrico ou adolescente foi relatado nesta coorte. Mais esforços devem ser feitos para responder a essas perguntas em estudos futuros. e valores de p não significativos não excluem necessariamente diferença entre pacientes de UTI e não UTI.
Finalmente, o possível viés de exposição em nosso estudo pode explicar por que nenhum paciente pediátrico ou adolescente foi relatado nesta coorte. Mais esforços devem ser feitos para responder a essas perguntas em estudos futuros.
Acredita-se que o SARS-CoV e o MERS-CoV tenham origem em morcegos, e essas infecções foram transmitidas diretamente aos seres humanos por civetas de mercado e camelos dromedários, respectivamente.35
Uma extensa pesquisa sobre SARS-CoV e MERS-CoV levou à descoberta de muitos coronavírus semelhantes a SARS e MERS em morcegos. Em 2013, Ge e colegas36.relataram toda a sequência do genoma de um coronavírus do tipo SARS em morcegos com essa capacidade de usar a ACE2 humana como um receptor, tendo, assim, potenciais de replicação em células humanas.37.
O 2019-nCoV ainda precisa ser estudado profundamente, caso se torne uma ameaça global à saúde. Testes rápidos e confiáveis de patógenos e diagnóstico diferencial viável com base na descrição clínica são cruciais para os médicos em seu primeiro contato com pacientes suspeitos. Devido ao potencial pandêmico de 2019-nCoV, uma vigilância cuidadosa é essencial para monitorar sua futura adaptação do hospedeiro, evolução viral, infectividade, transmissibilidade e patogenicidade.
Retirado de:
Chaolin Huang et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. The Lancet. 24 jan 2020. Available: https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)30183-5/fulltext#main-menu.






Comentários